Jeste li znali? Proces otkrivanja ljudskih bićavitrijabio je pun preokreta. 1787. Šveđanin Karl Axel Arrhenius slučajno je otkrio gustu i tešku crnu rudu u kamenolomu u blizini svog rodnog grada Ytterby Village i nazvao ga "ytterbite". Nakon toga, mnogi znanstvenici, uključujući Johan Gadolin, Anders Gustav Ekberg, Friedrich Wöhler i drugi, proveli su dubinska istraživanja ove rude.
1794. finski kemičar Johan Gadolin uspješno je odvojio novi oksid od Ytterbium rude i nazvao ga Ytrium. Ovo je bio prvi put da su ljudi jasno otkrili rijedak element Zemlje. Međutim, ovo otkriće nije odmah privuklo široku pažnju.
S vremenom su znanstvenici otkrili druge rijetke elemente Zemlje. 1803. njemački Klaproth i Šveđani Hitzinger i Berzelius otkrili su cerij. 1839. otkrio je Šveđanin Mosanderlantan. 1843. otkrio je Erbium iterbijum. Ova su otkrića pružila važan temelj za naknadna znanstvena istraživanja.
Tek krajem 19. stoljeća znanstvenici su uspješno odvojili element "ytrium" od ytrium rude. 1885. Austrijski Wilsbach otkrio je neodimij i praseodimij. 1886. otkrio je Bois-Baudrandisprozijum. Ova otkrića dodatno su obogatala veliku obitelj rijetkih zemaljskih elemenata.
Više od jednog stoljeća nakon otkrića ytriuma, zbog ograničenja tehničkih uvjeta, znanstvenici nisu bili u mogućnosti pročistiti ovaj element, što je također uzrokovalo neke akademske sporove i pogreške. Međutim, to nije spriječilo znanstvenike u njihovom entuzijazmu za proučavanje ytriuma.
Početkom 20. stoljeća, s kontinuiranim napredovanjem znanosti i tehnologije, znanstvenici su napokon počeli pročišćavati rijetke elemente Zemlje. 1901. otkrio je Francuz Eugene de Marseilleeuropijum. 1907-1908., Austrijski Wilsbach i Francuz Urbain neovisno su otkrili lutetium. Ova su otkrića pružila važan temelj za naknadna znanstvena istraživanja.
U modernoj znanosti i tehnologiji primjena ytriuma postaje sve opsežnija. Uz kontinuirani napredak znanosti i tehnologije, naše razumijevanje i primjena ytriuma postat će sve dublje.
Polja primjene ytrium elementa
1.Optička stakla i keramika:Ytrium se široko koristi u proizvodnji optičkog stakla i keramike, uglavnom u proizvodnji prozirne keramike i optičkog stakla. Njegovi spojevi imaju izvrsna optička svojstva i mogu se koristiti za izradu komponenti lasera, optičkih komunikacija i druge opreme.
2. Fosfor:Ytrium spojevi igraju važnu ulogu u fosforima i mogu emitirati svijetlu fluorescenciju, tako da se često koriste za proizvodnju TV ekrana, monitora i rasvjetne opreme.Ytrium oksidA drugi se spojevi često koriste kao luminescentni materijali za poboljšanje svjetline i jasnoće svjetlosti.
3. Aditivi za legure: U proizvodnji metalnih legura, ytrium se često koristi kao aditiv za poboljšanje mehaničkih svojstava i korozijske otpornosti metala.Legure ytriumčesto se koriste za izradu čelika visoke čvrstoće ialuminijske legure, čineći ih više otpornim na toplinu i otpornim na koroziju.
4. Katalizatori: Ytrium spojevi igraju važnu ulogu u nekim katalizatorima i mogu ubrzati brzinu kemijskih reakcija. Koriste se za izradu automobila za pročišćavanje automobila i katalizatore u procesima industrijske proizvodnje, pomažući u smanjenju emisije štetnih tvari.
5. Tehnologija medicinskog snimanja: Ytrium izotopi koriste se u tehnologiji medicinskog snimanja za pripremu radioaktivnih izotopa, poput označavanja radiofarmaceutica i dijagnosticiranja nuklearnog medicinskog snimanja.
6. Laserska tehnologija:Ytrium ionski laseri uobičajeni su laser u čvrstom stanju koji se koristi u različitim znanstvenim istraživanjima, laserskoj medicini i industrijskim primjenama. Proizvodnja ovih lasera zahtijeva uporabu određenih ytrium spojeva kao aktivatora.Yttrium elementiA njihovi spojevi igraju važnu ulogu u modernoj znanosti, tehnologiji i industriji, koja uključuju mnoga područja poput optike, znanosti o materijalima i medicine, te su dali pozitivan doprinos napretku i razvoju ljudskog društva.
Fizička svojstva ytriuma
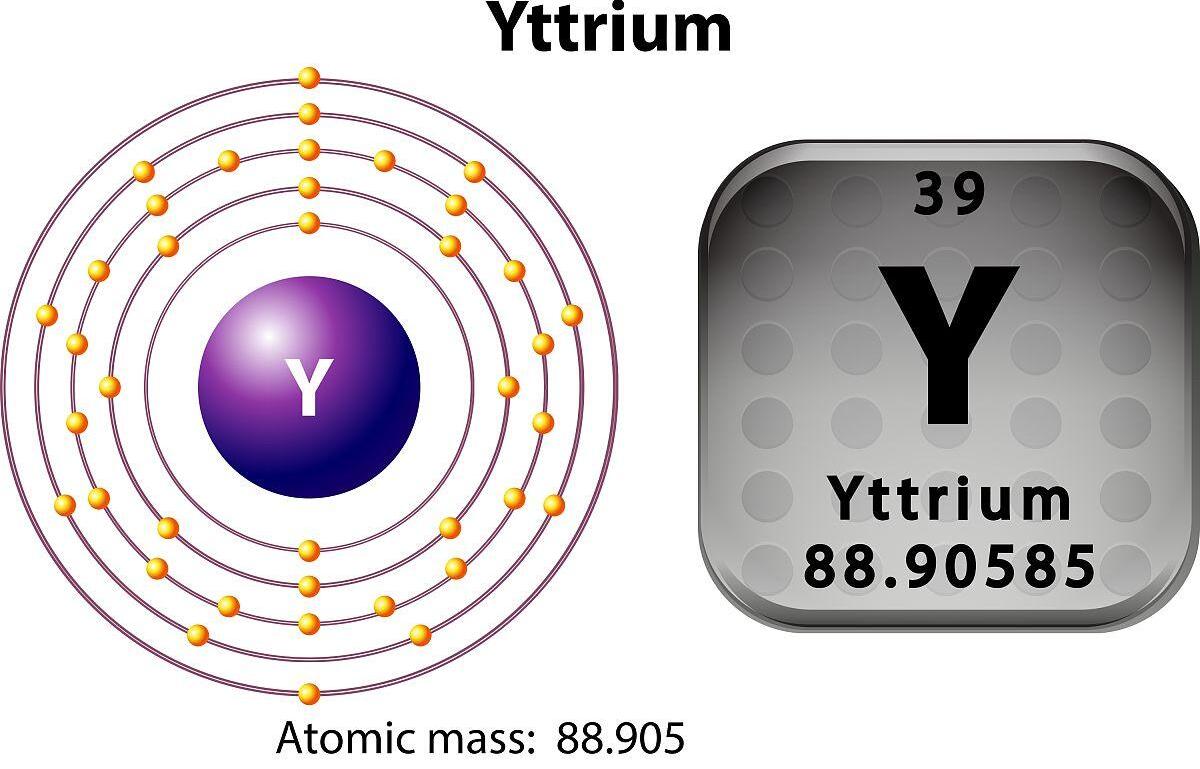
Atomski brojvitrijaje 39, a njegov kemijski simbol je Y.
1. Izgled:Ytrium je srebrno-bijeli metal.
2. Gustoća:Gustoća ytriuma je 4,47 g/cm3, što ga čini jednim od relativno teških elemenata u Zemljinoj kore.
3. Točka topljenja:Točka topljenja ytriuma iznosi 1522 Celzijusa (2782 stupnja Fahrenheita), što se odnosi na temperaturu na kojoj se ytrij mijenja iz krute u tekućinu u toplinskim uvjetima.
4. Točka ključanja:Točka ključanja ytriuma iznosi 3336 stupnjeva Celzijusa (6037 stupnjeva Fahrenheit), što se odnosi na temperaturu na kojoj se ytrium mijenja iz tekućine u plin u toplinskim uvjetima.
5. faza:Na sobnoj temperaturi, ytrium je u čvrstom stanju.
6. Vodljivost:Ytrium je dobar provodnik električne energije s velikom vodljivošću, tako da ima određene primjene u proizvodnji elektroničkih uređaja i tehnologiji kruga.
7. Magnetizam:Ytrium je paramagnetski materijal na sobnoj temperaturi, što znači da nema očigledan magnetski odgovor na magnetska polja.
8. Kristalna struktura: Ytrium postoji u šesterokutnoj kristalnoj strukturi blisko prepune.
9. Atomski volumen:Atomski volumen ytriuma je 19,8 kubičnih centimetara po molu, koji se odnosi na volumen koji je zauzeo jedan mol atoma ytrium.
Ytrium je metalni element s relativno visokom gustoćom i taljenjem, a ima dobru vodljivost, tako da ima važnu primjenu u elektronici, znanosti o materijalima i drugim poljima. Istodobno, ytrium je također relativno čest rijedak element, koji igra važnu ulogu u nekim naprednim tehnologijama i industrijskim primjenama.
Kemijska svojstva ytriuma
1. Kemijski simbol i skupina: Kemijski simbol ytriuma je Y, a nalazi se u petom razdoblju periodične tablice, treće skupine, koja je slična elementima lantanida.
2. Elektronička struktura: Elektronička struktura ytriuma je 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4P⁶ 4d¹⁰ 4f¹⁴ 5s². U vanjskom sloju elektrona, ytrium ima dva valentna elektrona.
3. Valentno stanje: Ytrium obično pokazuje valentno stanje od +3, što je najčešće stanje valencije, ali može pokazati i valentno stanje +2 i +1.
4. Reaktivnost: Ytrium je relativno stabilan metal, ali će se postupno oksidirati kada je izložen zraku, formirajući oksidni sloj na površini. Zbog toga je ytrium izgubio svoj sjaj. Da bi se zaštitila ytrium, obično se pohranjuje u suho okruženje.
5. Reakcija s oksidima: Ytrium reagira s oksidima kako bi tvorio različite spojeve, uključujućiytrium oksid(Y2o3). Ytrium oksid se često koristi za izradu fosfora i keramike.
6. ** Reakcija s kiselinama **: Ytrium može reagirati s jakim kiselinama kako bi proizveo odgovarajuće soli, poputytrium klorid (Ycl3) iliytrium sulfat (Y2 (SO4) 3).
7. Reakcija s vodom: Ytrium ne reagira izravno s vodom u normalnim uvjetima, ali pri visokim temperaturama može reagirati s vodenom parom da bi se proizvela vodikov i ytrijski oksid.
8. Reakcija sa sulfidima i karbidima: ytrium može reagirati sa sulfidima i karbidima kako bi se stvorio odgovarajući spojevi poput ytrium sulfida (YS) i ytrium karbida (YC2). 9. Izotopi: Ytrium ima više izotopa, od kojih je najstabilniji Ytrium-89 (^89Y), koji ima dug poluživot i koristi se u nuklearnoj medicini i označavanju izotopa.
Ytrium je relativno stabilan metalni element s više valentnih stanja i mogućnost reakcije s drugim elementima kako bi se formirali spojevi. Ima širok raspon primjena u optici, znanosti o materijalima, medicini i industriji, posebno u fosforu, proizvodnji keramike i laserskoj tehnologiji.
Biološka svojstva ytriuma
Biološka svojstvavitrijaU živim su organizmi relativno ograničeni.
1. Prisutnost i gutanje: Iako ytrium nije element bitan za život, u prirodi se mogu naći količine u tragovima, uključujući tlo, stijene i vodu. Organizmi mogu gutati u tragovima količine ytriuma kroz prehrambeni lanac, obično iz tla i biljaka.
2. Bioraspoloživost: Bioraspoloživost ytriuma je relativno niska, što znači da organizmi uglavnom imaju poteškoće u apsorpciji i učinkovitoj upotrebi ytriuma. Većina ytrium spojeva se ne apsorbira lako u organizmima, pa se obično izlučuju.
3. Raspodjela u organizmima: Jednom u organizmu, ytrium se uglavnom distribuira u tkivima kao što su jetra, bubreg, slezina, pluća i kosti. Kosti, kosti sadrže veće koncentracije ytriuma.
4. Metabolizam i izlučivanje: Metabolizam ytriuma u ljudskom tijelu je relativno ograničen jer obično ostavlja organizam izlučivanjem. Većina se izlučuje kroz urin, a može se izlučiti i u obliku defekacije.
5. Toksičnost: Zbog male bioraspoloživosti, ytrium se obično ne nakuplja na štetne razine u normalnim organizmima. Međutim, izloženost ytriumu s visokim dozama može imati štetne učinke na organizme, što dovodi do toksičnih učinaka. Ova se situacija obično događa rijetko zato što su koncentracije ytrijuma u prirodi obično niske i ne koristi se široko korištenim ili izloženim organizmima. Biološke karakteristike ytriuma u organizmima se uglavnom očituju u njegovoj prisutnosti u količinama u tragovima, niskoj bioraspoloživosti, a ne predstavljaju element potreban za život. Iako nema očigledne toksične učinke na organizme u normalnim okolnostima, izloženost visokog doze može uzrokovati opasnosti zdravlja. Stoga su znanstvena istraživanja i nadzor još uvijek važni za sigurnosne i biološke učinke ytriuma.
Raspodjela ytriuma u prirodi
Ytrium je rijedak zemaljski element koji je relativno široko raspoređen u prirodi, iako ne postoji u čistom elementarnom obliku.
1. Pojava u Zemljinoj kore: Obilje vitrija u Zemljinoj kore je relativno nisko, s prosječnom koncentracijom od oko 33 mg/kg. To čini ytrium jednim od rijetkih elemenata.
Ytrium uglavnom postoji u obliku minerala, obično zajedno s drugim rijetkim zemaljskim elementima. Neki glavni minerali Ytrium uključuju granat od željeza ytrium (YIG) i ytrium oksalat (Y2 (C2O4) 3).
2. Geografska distribucija: depoziti ytrium distribuiraju se u cijelom svijetu, ali neka područja mogu biti bogata ytrium. Neki glavni depoziji ytriuma mogu se naći u sljedećim regijama: Australija, Kina, Sjedinjene Države, Rusija, Kanada, Indija, Skandinavija itd. 3. Ekstrakcija i obrada: Jednom kada se ruda ytrium minira, obično je potrebna kemijska obrada za izdvajanje i odvojenost ytriuma. To obično uključuje postupke razdvajanja kiseline i kemijskog odvajanja kako bi se dobila ytrium visoke čistoće.
Važno je napomenuti da rijetki elementi Zemlje poput ytriuma obično ne postoje u obliku čistih elemenata, već su pomiješani s drugim rijetkim elementima Zemlje. Stoga, ekstrakcija veće čistoće Ytrium zahtijeva složene procese kemijske obrade i odvajanja. Pored toga, opskrbaRijetki zemljani elementije ograničeno, pa je također važno razmatranje njihovog upravljanja resursima i održivosti okoliša.
Rudarstvo, ekstrakcija i topljenje elementa ytrium
Ytrium je rijedak zemaljski element koji obično ne postoji u obliku čistog ytriuma, već u obliku ytrium rude. Slijedi detaljan uvod u postupak rudarstva i rafiniranja ytrium elementa:
1. Rudarstvo ytrium rude:
Istraživanje: Prvo, geolozi i rudarski inženjeri provode istraživačke radove kako bi pronašli naslage koje sadrže ytrium. To obično uključuje geološke studije, geofizičko istraživanje i analizu uzoraka. Rudarstvo: Jednom kada se nalazi depozit koji sadrži ytrium, ruda se minira. Ove naslage obično uključuju oksidne rude kao što su vironski granat od ytrium (YIG) ili ytrium oksalat (Y2 (C2O4) 3). Ruda za drobljenje: Nakon rudarstva rudu se obično treba razbiti na manje komade za naknadnu obradu.
2. Izdvajanje ytrium:Kemijsko ispiranje: Drobljena ruda obično se šalje na topionicu, gdje se ytrium ekstrahira kemijskim ispiranjem. Ovaj postupak obično koristi kiselu otopinu ispiranja, poput sumporne kiseline, za otapanje ytrium iz rude. Odvajanje: Jednom kada se ytrium otopi, obično se miješa s drugim rijetkim zemaljskim elementima i nečistoćama. Da bi se izvukao ytrium veće čistoće, potreban je postupak odvajanja, obično pomoću ekstrakcije otapala, razmjene iona ili drugih kemijskih metoda. Oborine: Ytrium je odvojen od drugih rijetkih zemaljskih elemenata odgovarajućim kemijskim reakcijama kako bi se stvorio čisti Ytrium spojevi. Sušenje i kalcinacija: Dobiveni ytrijski spojevi obično se moraju osušiti i kalcinirati kako bi se uklonili bilo kakvu zaostalu vlagu i nečistoće kako bi se konačno dobilo čisti metal ili spojevi.
Metode otkrivanja ytriuma
Uobičajene metode otkrivanja za ytrium uglavnom uključuju atomsku apsorpcijsku spektroskopiju (AAS), induktivno povezanu spektrometriju mase u plazmi (ICP-MS), rendgenski fluorescentna spektroskopija (XRF) itd.
1. atomska apsorpcijska spektroskopija (AAS):AAS je najčešće korištena metoda kvantitativne analize pogodna za određivanje sadržaja ytriuma u otopini. Ova se metoda temelji na fenomenu apsorpcije kada ciljni element u uzorku apsorbira svjetlost određene valne duljine. Prvo, uzorak se pretvara u mjerljivi oblik kroz korake prethodne obrade kao što su izgaranje plina i sušenje visoke temperature. Zatim se svjetlost koja odgovara valnoj duljini ciljnog elementa prenosi u uzorak, mjeri se intenzitet svjetlosti apsorbiran uzorak, a sadržaj ytriuma u uzorku izračunava se usporedbom sa standardnom otopinom YTT -a poznate koncentracije.
2. Induktivno spojena spektrometrija mase u plazmi (ICP-MS):ICP-MS je vrlo osjetljiva analitička tehnika pogodna za određivanje sadržaja ytriuma u tekućim i čvrstim uzorcima. Ova metoda pretvara uzorak u nabijene čestice, a zatim koristi maseni spektrometar za analizu mase. ICP-MS ima širok raspon otkrivanja i visoku razlučivost i može istovremeno odrediti sadržaj više elemenata. Za otkrivanje ytriuma, ICP-MS može osigurati vrlo male granice otkrivanja i visoku točnost.
3. Rendgenska fluorescentna spektrometrija (XRF):XRF je nerazorna analitička metoda pogodna za određivanje sadržaja ytriuma u čvrstim i tekućim uzorcima. Ova metoda određuje sadržaj elemenata ozračivanjem površine uzorka rendgenskim zrakama i mjerenjem karakterističnog vršnog intenziteta fluorescentnog spektra u uzorku. XRF ima prednosti brze brzine, jednostavne operacije i mogućnost određivanja više elemenata istovremeno. Međutim, XRF se može ometati u analizi YTTrija s niskim sadržajem, što rezultira velikim pogreškama.
4. Neumoćno spojena spektrometrija optičke emisije u plazmi (ICP-OES):Induktivno povezana spektrometrija optičke emisije u plazmi vrlo je osjetljiva i selektivna analitička metoda koja se široko koristi u analizi multi-elementa. Atomizira uzorak i tvori plazmu za mjerenje specifične valne duljine i intenziteta of ytriumEmisija u spektrometru. Pored gore navedenih metoda, postoje i druge najčešće korištene metode za otkrivanje ytriuma, uključujući elektrokemijsku metodu, spektrofotometriju itd. Odabir odgovarajuće metode otkrivanja ovisi o faktorima kao što su svojstva uzorka, potrebni raspon mjerenja i točnost otkrivanja, a za kontrolu kvalitete često su potrebni za kontrolu kvalitete.
Specifična primjena metode apsorpcije atomske ytrium
U mjerenju elemenata, induktivno spojena spektrometrija mase u plazmi (ICP-MS) vrlo je osjetljiva tehnika analize multi-elementa, koja se često koristi za određivanje koncentracije elemenata, uključujući ytrium. Slijedi detaljan postupak za testiranje ytriuma u ICP-MS:
1. Priprema uzorka:
Uzorak se obično mora otopiti ili raspršiti u tekući oblik za ICP-MS analizu. To se može postići kemijskim otapanjem, digestijom zagrijavanja ili drugim odgovarajućim metodama pripreme.
Priprema uzorka zahtijeva izuzetno čiste uvjete kako bi se spriječilo onečišćenje bilo kojim vanjskim elementima. Laboratorij bi trebao poduzeti potrebne mjere kako bi se izbjeglo onečišćenje uzorka.
2. ICP generacija:
ICP se generira uvođenjem miješanog plina Argon ili Argon-kisik u zatvorenu bakljama od kvarcne plazme. Visokofrekventno induktivno spajanje proizvodi intenzivan plazma plamen, što je polazište analize.
Temperatura plazme iznosi oko 8000 do 10000 stupnjeva Celzijusa, što je dovoljno visok da elemente u uzorku pretvori u ionsko stanje.
3. ionizacija i razdvajanje:Jednom kada uzorak uđe u plazmu, elementi u njemu su ionizirani. To znači da atomi gube jedan ili više elektrona, formirajući nabijene ione. ICP-MS koristi maseni spektrometar za odvajanje iona različitih elemenata, obično prema omjeru mase i naboja (m/z). To omogućava da se ioni različitih elemenata razdvajaju i nakon toga analiziraju.
4. Masena spektrometrija:Razdvojeni ioni ulaze u maseni spektrometar, obično maseni spektrometar četveropola ili magnetski spektrometar magnetskog skeniranja. U masenom spektrometru, ioni različitih elemenata razdvajaju se i otkrivaju prema njihovom omjeru mase i naboja. To omogućava utvrđivanje prisutnosti i koncentracije svakog elementa. Jedna od prednosti induktivno povezane spektrometrije mase plazme je njegova visoka rezolucija, što mu omogućuje istovremeno otkrivanje više elemenata.
5. Obrada podataka:Podaci generirani ICP-MS-om obično se moraju obraditi i analizirati kako bi se utvrdila koncentracija elemenata u uzorku. To uključuje usporedbu otkrivanja signala sa standardima poznatih koncentracija i provođenje kalibracije i korekcije.
6. Izvještaj o rezultatima:Konačni rezultat predstavljen je kao koncentracija ili masovni postotak elementa. Ovi se rezultati mogu koristiti u raznim primjenama, uključujući znanost o zemlji, analizu okoliša, testiranje hrane, medicinska istraživanja itd.
ICP-MS je vrlo precizna i osjetljiva tehnika pogodna za analizu s više elemenata, uključujući ytrium. Međutim, ona zahtijeva složenu instrumentaciju i stručnost, tako da se obično izvodi u laboratoriju ili profesionalnom centru za analizu. U stvarnom radu potrebno je odabrati odgovarajuću metodu mjerenja prema specifičnim potrebama web mjesta. Ove se metode široko koriste u analizi i otkrivanju ytterbiuma u laboratorijima i industrijama.
Nakon sažetka gore navedenog, možemo zaključiti da je ytrium vrlo zanimljiv kemijski element s jedinstvenim fizičkim i kemijskim svojstvima, što je od velikog značaja u znanstvenim istraživanjima i poljima primjene. Iako smo postigli određeni napredak u našem razumijevanju, još uvijek postoje mnoga pitanja koja trebaju daljnja istraživanja i istraživanje. Nadam se da će naš uvod može pomoći čitateljima da bolje razumiju ovaj fascinantan element i potaknu svačiju ljubav prema znanosti i zanimanje za istraživanje.
Za više informacija plskontaktirajte nasispod:
Tel & Whats: 008613524231522
Email:Sales@shxlchem.com
Post Vrijeme: studeni-28-2024