Јесте ли знали? Процес људских бића које откривајуиттриумбило је пуно завоја и изазова. 1787. године, Швеђанин Карл Акел Аррениус је случајно открио густу и тешку црну руду у каменолому у близини свог родног града Иттерби Виллаге и назвао га "ИТТерБите". Након тога, многи научници, укључујући Јохана Гадолин, Андерса Густава Екберга, Фриедрицх Вохлера и остале спровели су дубински истраживачки у ову руду.
1794. године фински хемичар Јохан Гадолин успешно је одвојио нови оксид од иттербиум руде и именовао је ИТтриум. Ово је први пут да су људи јасно открили ретки елемент Земље. Међутим, ово откриће није одмах привукло раширену пажњу.
Временом су научници открили остале ретке земље Земље. 1803. године, немачки клапротх и Швеђани Хитзингер и Берзелиус открили су церијум. 1839. године, открио је Швеђанин Мосандарлантханум. 1843. открио је Ербиум итербијум. Ова открића пружила су важну основу за наредна научна истраживања.
До краја 19. века научници су успешно раздвојили елемент "ИТТРИУМ" из ИТТРИУМ руде. 1885. године, аустријски Вилсбацх открио је неодимијум и прасеодимијум. 1886. године је открио Боис-Баудрандиспросиум. Ова открића су додатно обогаћала велику породицу ретких земаљских елемената.
Више од једног века након открића ИТТРИУМ-а, због ограничења техничких услова, научници нису у стању да пречисти овај елемент, који је такође изазвао неке академске спорове и грешке. Међутим, то није зауставило научнике из свог ентузијазма за проучавање ИТтријума.
Почетком 20. века, са сталним унапређењем науке и технологије, научници су коначно почели да пречисте ретке елементе Земље. 1901. године, Француз Еугене де Марсеилле је откриоевропијум. 1907-1908, Аустријски Вилсбацх и Француз Урбаин су независно открили лутетијум. Ова открића пружила су важну основу за наредна научна истраживања.
У савременој науци и технологији, примена ИТТРИУМ-а постаје све опсежнија. Уз континуирано напредовање науке и технологије, наше разумевање и наношење ИТТРИУМ-а постаће све дубље.
Примена елемента ИТТРИУМ
1.Оптичко стакло и керамика:ИТтриум се широко користи у производњи оптичког стакла и керамике, углавном у производњи прозирне керамике и оптичког стакла. Његова једињења имају одлична оптичка својства и могу се користити за производњу компоненти ласера, оптичких оптичких комуникација и друге опреме.
2 Фосфор:ИТТРИУМ једињења играју важну улогу у фосфорима и могу да емитују светлу флуоресценцију, тако да се често користе за производњу ТВ екрана, монитора и опреме за осветљење.Итријум оксиди друга једињења се често користе као луминесцентне материјале за побољшање светлине и јасноће светлости.
3. адитиви за легуре: У производњи металних легура итријум се често користи као адитив за побољшање механичких својстава и отпорности на корозију метала.ИТтриум легуречесто се користе за прављење челика велике чврстоће иАлуминијумске легуре, чинећи их више топлотних отпоран на топлоту и отпорни на корозију.
4. катализатори: Итријум једињења играју важну улогу у неким катализаторима и могу убрзати стопу хемијских реакција. Користе се за производњу уређаја за пречишћавање аутомобила и катализатора у процесима индустријске производње, помажући да се смањи емисија штетних материја.
5. Технологија медицинске слике: ИТТРИУМ ИСОТОПЕС се користе у технологији медицинског слика за припрему радиоактивних изотопа, као што су радиофармацеутски и дијагностицирање нуклеарног медицинског лекара.
6 Ласерска технологија:ИТТРИУМ ИОН ласери су уобичајено чврсто стање у чврстом стању који се користи у разним научноистраживачким истраживањима, ласерској медицини и индустријским апликацијама. Производња ових ласера захтева употребу одређених иТтријумских једињења као активатора.Итријум елементиА њихова једињења играју важну улогу у савременој науци и технологији и индустрији, укључујући многа поља као што су оптика, наука о материјалима и медицини и дали су позитивни допринос напретку и развоју људског друштва.
Физичка својства ИТтријума
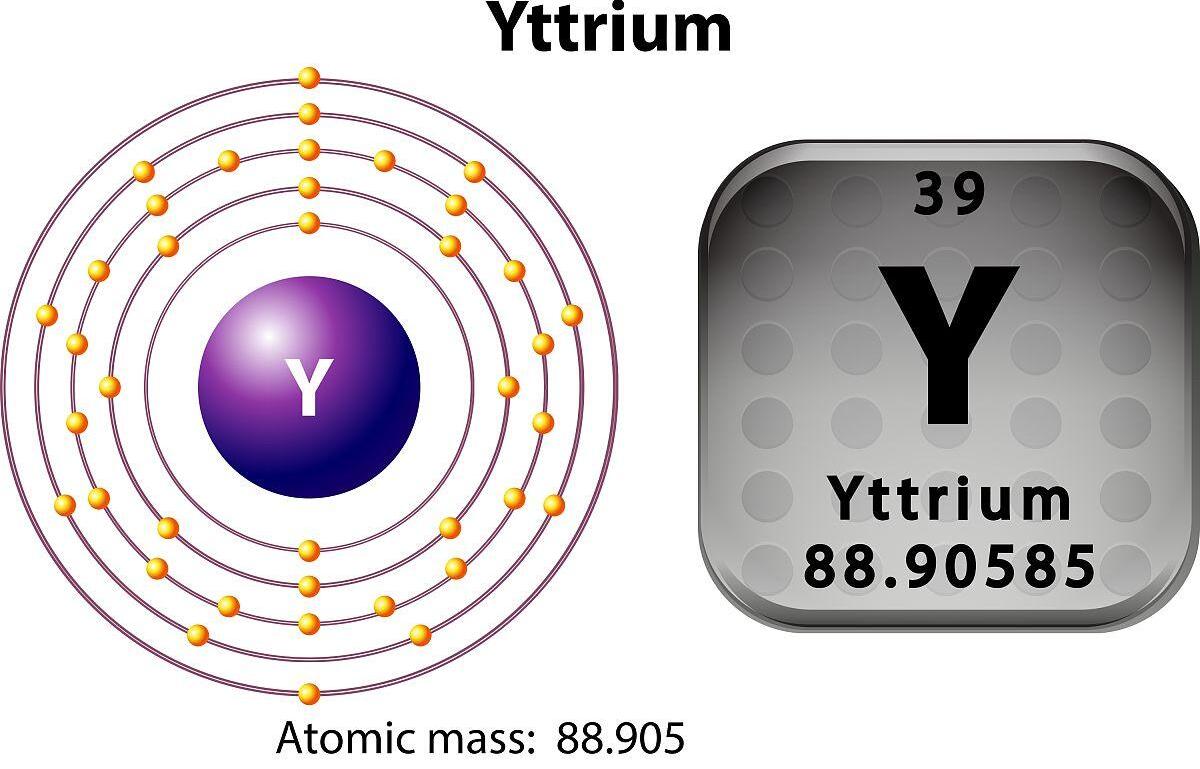
Атомски бројиттриумје 39 и њен хемијски симбол је И.
1. Изглед:ИТТРИУМ је сребрни-бели метал.
2 Густина:Густина ИТТРИУМ је 4,47 г / цм3, што га чини једном од релативно тешких елемената у земљиној кори.
3. Тачка топљења:Тачка топљења ИТТРИУМ је 1522 степени Целзијуса (2782 степени Фаренхеита), која се односи на температуру на којој се ИТТРИУМ мења из чврсте супстанце до течности под термичким условима.
4. Тачка кључања:Тачка кључања ИТТРИУМ је 3336 степени Целзијуса (6037 степени Фаренхеита), која се односи на температуру на којој се ИТТРИУМ мења из течности до гаса под топлотним условима.
5. Фаза:На собној температури итријум је у чврстом стању.
6 Проводљивост:ИТТРИУМ је добар проводник електричне енергије са високом проводљивошћу, тако да има одређене апликације у електронској производњи и технологији круга.
7. магнетизам:ИТТРИУМ је парамагнетски материјал на собној температури, што значи да нема очигледан магнетни одговор на магнетна поља.
8. Кристална структура: ИТТРИУМ постоји у шестерокутне кристалне структуре у близини.
9. Атомска јачина звука:Атомска запремина ИТТРИУМ је 19,8 кубичних центиметара по молу, која се односи на обим који заузима један мол итријум атома.
ИТТРИУМ је метални елемент са релативно високом тачком густине и топљења и има добру проводљивост, тако да има важне примене у електроничкој, науци о материјалима и другим пољима. Истовремено, ИТТРИУМ је такође релативно заједнички ретки елемент који игра важну улогу у неким напредним технологијама и индустријским апликацијама.
Хемијска својства ИТтријума
1. Хемијски симбол и група: Хемијски симбол ИТТРИУМ је И, а налази се у петом периоду периодичне табеле, треће групе, што је слично лантханидним елементима.
2 Електронска структура: Електронска структура ИТТРИУМ је 1С² 2С² 2П⁶ 3С² 3П³ 3Д¹⁰ 4С² 4П⁶ 4Д¹⁰ 4Ф¹⁴ 5С². У спољњем електроничком слоју ИТтријум има две електроне валенције.
3. Држава Валенце: ИТтриум обично приказује стање валенције +3, што је најчешће држава валенције, али такође може показати ставове о валенцији од +2 и +1.
4. Реактивност: ИТтриум је релативно стабилан метал, али постепено ће се оксидирати када је изложен ваздуху, формирајући оксидни слој на површини. То изазива итријум да изгуби сјај. Да би се заштитила ИТтријума, обично се чува у сувом окружењу.
5. Реакција са оксидима: ИТтријум реагује са оксидима да формирају различита једињења, укључујућиитријум оксид(И2о3). Итријум оксид се често користи за прављење фосфора и керамике.
6 ** Реакција са киселинама **: иТтријум може реаговати са јаким киселинама за производњу одговарајућих соли, као што суИТТРИУМ хлорид (Ицл3) илиИТТРИУМ СУЛФАТЕ (И2 (СО4) 3).
7. Реакција са водом: ИТТРИУМ не реагује директно са водом у нормалним условима, већ на високим температурама, може да реагује са воденом паром да би се створила водонични и итријум оксид.
8 Реакција са сулфидима и карбидима: ИТТРИУМ може да реагује са сулфидима и карбидима да формирају одговарајућа једињења као што су ИТТРИУМ СУЛФИДЕ (ИС) и ИТТРИУМ ЦАРБИДЕ (ИЦ2). 9. Изотопи: ИТТРИУМ има више изотопа, од којих је најстабилније ИТТРИУМ-89 (^ 89И), који има дуг полуживот и користи се у нуклеарној медицини и означавању изотопа.
ИТТРИУМ је релативно стабилан метални елемент са више држава валенције и могућност реаговања са другим елементима за формирање једињења. Има широк спектар апликација у оптици, науци о материјалима, медицини и индустрији, посебно у фосфорима, керамичкој производњи и ласерској технологији.
Биолошка својства ИТтријума
Биолошка својстваиттриумУ живим организмима су релативно ограничени.
1. Присутност и гутање: Иако ИТТРИУМ није елемент који је неопходан за живот, количине ИТтријума у траговима могу се наћи у природи, укључујући тло, стијене и воду. Организми могу гутати количине итријума у траговима кроз прехрамбени ланац, обично од тла и биљака.
2 Биообрабилност: биорасположивост ИТтријума је релативно ниска, што значи да организми углавном имају потешкоће у апсорпцији и ефикасно коришћење иТтријума. Већина итријумских једињења се не апсорбује у организмима, тако да се обично излучују.
3. Дистрибуција у организмима: Једном у организму итријум се углавном дистрибуира у ткивима попут јетре, бубрега, слезине, плућа и костију. Конкретно, кости садрже веће концентрације ИТтријума.
4. Метаболизам и излучивање: метаболизам итријума у људском телу је релативно ограничен јер обично оставља организам излучивањем. Већина га се излучује кроз урин, а може се такође излучити у облику дефекације.
5. Токсичност: Због ниске биорасположивости, ИТтријум се обично не скупља на штетне нивое у нормалним организмима. Међутим, експозиција иттријума високе дозе може имати штетне утицаје на организме, што доводи до токсичних ефеката. Ова ситуација се обично јавља ретко јер су концентрације итријума у природи ниске и нису широко коришћене или изложене организмима. Биолошке карактеристике ИТтријума у организмима углавном се манифестују у његовом присуству у количини у траговима, ниску биорасположивост, а ниску биорасположивост. Иако нема очигледних токсичних ефеката на организме у нормалним околностима, изложеност високих доза може изазвати опасности по здравље. Стога су научна истраживања и праћење и даље важна за сигурност и биолошке ефекте ИТТРИУМ-а.
Дистрибуција итријума у природи
ИТТРИУМ је ретки земљани елемент који је релативно широко дистрибуиран у природи, мада не постоји у чистом елементарном облику.
1. Појава у земљиној коре: обиље ИТтријума у Земљиној коре је релативно ниска, са просечном концентрацијом од око 33 мг / кг. То чини иТтријума једним од ретких елемената.
ИТтриум углавном постоји у облику минерала, обично заједно са осталим ретким земљаним елементима. Неки главни иТтријум минерали укључују ИТТРИУМ ИРОН ГАРНЕТ (ИИГ) и ИТТРИУМ ОКАЛАТТЕ (И2 (Ц2О4) 3).
2 Географска дистрибуција: ИТТРИУМ депозити се дистрибуирају широм света, али нека подручја могу бити богата итријумом. Неки главни лежишта ИТТРИУМ-а могу се наћи у следећим регионима: Аустралија, Кина, Сједињене Државе, Русија, Канада, Индија, Сцандинавиа, итд. 3. Екстракција и обрада: Једном када је ИТТРИУМ руде минирана, хемијска обрада обично је потребна за извод и одвајање ИТтријума. То обично укључује кисело испирање и хемијски процеси за одвајање за добијање итријум високе чистоће.
Важно је напоменути да су ретки елементи Земље попут ИТТРИУМ-а обично не постоје у облику чистих елемената, већ су помешани са другим ретким земљаним елементима. Стога вађење веће чистоће ИТтријума захтева сложене хемијске процесе за прераду и одвајање. Поред тога, понудаРетки елементи Земљеје такође важно је ограничено, па је разматрање њиховог управљања ресурсима и одрживост животне средине.
Рударство, екстракција и топљење иттријум елемента
ИТТРИУМ је ретки земљани елемент који обично не постоји у облику чисте итријума, већ у облику иттријума руде. Следе детаљан увод у пројекат рударства и рафинирања ИТТРИУМ елемента:
1. Рударство ИТТРИУМ руде:
Истраживање: Прво, геолози и рударско инжењери врше истраживање и истраживање на проналажењу депозита који садрже ИТТРИУМ. То обично укључује геолошке студије, геофизичко истраживање и анализу узорка. Рударство: Једном када се нађе депозит који садржи ИТТРИУМ, руда је минирана. Ови депозити обично укључују оксидне руде као што су ИТТриум Ирон Гарнет (ИИГ) или ИТТриум оксалат (И2 (Ц2О4) 3). Рушење руде: Након рударства, руде обично треба да се прекине на мање комаде за накнадну обраду.
2 Вађење ИТТРИУМ:Хемијско испирање: дробљена руда се обично шаље на топилошњу топионицу, где се итријум екстрахује хемијским испирањем. Овај процес обично користи кисело раствор за испирање, као што је сумпорна киселина, како би растворила итријум из руде. Одвајање: Једном када је ИТТРИУМ растворен, то се обично меша са другим ретким земљаним елементима и нечистоћима. Да би се извукла иТтријума веће чистоће, потребан је поступак раздвајања, обично користећи екстракцију растварача, јонске размене или друге хемијске методе. Падавине: итриум се одвоји од осталих ретких елемената Земље кроз одговарајуће хемијске реакције да би се формирала чиста итријум једињења. Сушење и калцинација: Добијени итријум једињења обично се морају осушити и калцитирати да би се уклонило било коју преосталу влагу и нечистоће како би коначно добио чисти ИТтријум метал или једињења.
Методе детекције иттријума
Уобичајене методе детекције за ИТТРИУМ углавном укључују атомску апсорпциону спектроскопију (ААС), индуктивно спојену масу плазме (ИЦП-МС), рендгенски флуоресцентни спектроскопија (КСРФ) итд.
1. Атомска апсорпциона спектроскопија (ААС):ААС је уобичајена метода квантитативне анализе погодна за одређивање садржаја ИТТРИУМ у раствору. Ова метода се заснива на феномену апсорпције када циљни елемент у узорку апсорбује светлост одређене таласне дужине. Прво, узорак се претвара у мерљиви облик кроз кораке за претходну обраду, као што су сагоревање гаса и сушење на високом температуру. Затим се у узорку доноси лампица која одговара таласној дужини циљног елемента, мери се интензитет светлости узорак и садржај иТтријума у узорку се израчунава упоређујући га са стандардним иТтријумним раствором познате концентрације.
2 Индуктивно спојена масена спектрометрија у плазми (ИЦП-МС):ИЦП-МС је високо осетљива аналитичка техника погодна за одређивање садржаја ИТТРИУМ у течним и чврстим узорцима. Ова метода претвара узорак у наплаћене честице, а затим користи масовни спектрометар за масовну анализу. ИЦП-МС има широк распон детекције и високу резолуцију и може истовремено да одреди садржај више елемената. За откривање ИТТРИУМ-а, ИЦП-МС може пружити врло ниске границе детекције и високу тачност.
3. Рендгенска флуоресцентна спектрометрија (КСРФ):КСРФ је неразорна аналитичка метода погодна за одређивање садржаја иТтријума у чврстим и течним узорцима. Ова метода одређује садржај елемента зрачивањем површине узорка са рендгенским зрацима и мери карактеристичан врхунски интензитет флуоресцентне спектра у узорку. КСРФ има предности брзе брзине, једноставне операције и могућност утврђивања више елемената истовремено. Међутим, КСРФ се може ометати у анализу итријума са ниским садржајем, што резултира великим грешкама.
4. Индуктивно спојена у плазми оптичка спектрометрија емисије (ИЦП-ОЕС):Индуктивно спојена Спектрометрија оптичке емисије у плазми је веома осетљива и селективна аналитичка метода широко се користи у анализи вишедела. Атомизује узорак и формира плазму за мерење специфичне таласне дужине и интензитет оф итриумЕмисија у спектрометру. Поред горе наведених метода, постоје и друге уобичајене методе детекције ИТТРИУМ, укључујући електрохемијску методу, спектрофотометрија итд. Избор погодне методе детекције зависи од фактора као што су својства узорка, потребна спектра за мерење и стандарди за уклањање и калибрациони стандарди и поузданост резултата мерења и поузданост резултата мерења и поузданост резултата мерења и поузданост резултата мерења и поузданост резултата мерења и поузданост резултата мерења и поузданост резултата мерења и поузданост резултата мерења и поузданост резултата мерења и поузданост резултата мерења и лакора.
Специфична примена методе апсорпције иТтријум атомске апсорпције
У мерењу елемената, индуктивно спојена маса у плазми (ИЦП-МС) је високо осетљива и техника анализе на више елемената, која се често користи за утврђивање концентрације елемената, укључујући иТтријума. Следе детаљан поступак за тестирање ИТТРИУМ-а у ИЦП-МС:
1. Припрема узорка:
Узорак обично мора бити растворен или растрошен у течни облик за ИЦП-МС анализу. То се може учинити хемијским растварањем, варењем грејања или другим одговарајућим методама припреме.
Припрема узорка захтева изузетно чисте услове за спречавање контаминације било којим спољним елементима. Лабораторија треба да предузме неопходне мере да се избегне контаминација узорка.
2 Генерација ИЦП-а:
ИЦП се генерише увођењем аргона или аргон-кисеоника мешовите гаса у затворену кварц плазму. Високофреквентно индуктивно спојница производи интензивну плазму пламе, које је полазиште анализе.
Температура плазме је око 8000 до 10000 степени Целзијуса, која је довољно висока да претвори елементе у узорку у јонско стање.
3. Ионизација и одвајање:Једном када узорак уђе у плазму, елементи у њему су јонизовани. То значи да атоми губе један или више електрона, формирајући наплаћене јоне. ИЦП-МС користи масовни спектрометар за раздвајање јона различитих елемената, обично од омјера масовне наводе (м / з). То омогућава да се јони различитих елемената одвоје и накнадно анализирају.
4. Масена спектрометрија:Раздвојене јони улазе у масовни спектрометар, обично квадри масени спектрометар или магнетни масни спектрометар. У масовном спектрометру, јони различитих елемената су одвојени и откривени у складу са њиховим коефицијером за масовност. То омогућава утврђивање присутности и концентрације сваког елемента. Једна од предности индуктивне спојене масене спектрометрије у плазми је његова висока резолуција, што му омогућава да истовремено открије више елемената.
5. Обрада података:Подаци које је добио ИЦП-МС обично треба да се обрађују и анализирају да би се утврдила концентрација елемената у узорку. Ово укључује упоређивање сигнала за откривање стандардима познатих концентрација и обављања калибрације и корекције.
6 Извештај о резултатима:Коначни резултат је представљен као концентрација или масовни проценат елемента. Ови резултати се могу користити у различитим апликацијама, укључујући науку о Земаљској, анализи заштите животне средине, испитивање хране, медицинска истраживања итд.
ИЦП-МС је веома тачна и осетљива техника погодна за анализу са више елемената, укључујући итријум. Међутим, захтева сложену инструментацију и стручност, тако да се обично изводи у лабораторији или професионалном центру за анализу. У стварном раду потребно је одабрати одговарајућу методу мерења у складу са специфичним потребама локације. Ове методе се широко користе у анализи и откривању иттербијума у лабораторијама и индустријама.
Након резимирања горе наведеног, можемо закључити да је ИТТРИУМ врло занимљив хемијски елемент са јединственим физичким и хемијским својствима, што је од великог значаја у научној истраживачкој и апликационим пољима. Иако смо постигли одређени напредак у разумевању тога, још увек постоји много питања која су потребна даља истраживања и истраживање. Надам се да ће наше уношење моћи помоћи читаоцима да боље разумеју овај фасцинантни елемент и надахњују све љубав према науци и интересовању за истраживање.
За више информација плсКонтактирајте насИспод:
Тел & Вхатс: 008613524231522
Email:Sales@shxlchem.com
Вријеме поште: Нов-28-2024