Tudta? Az emberek felfedezésének folyamataittriumtele volt csavarokkal és kihívásokkal. 1787 -ben a svéd Karl Axel Arrhenius véletlenül felfedezte egy sűrű és nehéz fekete ércet egy kőbányában szülővárosában, Ytterby falu közelében, és "Ytterbite" -nek nevezte. Ezt követően sok tudós, köztük Johan Gadolin, Anders Gustav Ekberg, Friedrich Wöhler és mások mélyreható kutatást végeztek erről az ércről.
1794 -ben a finn kémikus, Johan Gadolin sikeresen elválasztotta az új oxidot a Ytterbium Ore -től, és it yttriumnak nevezte. Ez volt az első alkalom, amikor az emberek egyértelműen felfedezték a ritkaföldfémi elemet. Ez a felfedezés azonban nem vonzza azonnal a széles körű figyelmet.
Az idő múlásával a tudósok más ritkaföldfémi elemeket fedeztek fel. 1803 -ban a német Klaproth és a svédek Hitzinger és Berzelius felfedezték a Ceriumot. 1839 -ben a svéd Mosader felfedeztelantán- 1843 -ban felfedezte Erbiumot ésterbium- Ezek a felfedezések fontos alapot nyújtottak a későbbi tudományos kutatásokhoz.
A tudósok csak a 19. század végéig választották el a "yttrium" elemet a Yttrium ércétől. 1885 -ben az osztrák Wilsbach felfedezte a neodímiumot és a Praseodímiumot. 1886-ban Bois-Baudran felfedeztediszprosium- Ezek a felfedezések tovább gazdagították a ritkaföldfémek nagy családját.
A műszaki feltételek korlátozása miatt a Yttrium felfedezése után több mint egy évszázaddal a tudósok nem tudták megtisztítani ezt az elemet, ami szintén okozott néhány tudományos vitát és hibát. Ez azonban nem akadályozta meg a tudósokat a lelkesedésüktől a Yttrium tanulmányozása iránt.
A 20. század elején, a tudomány és a technológia folyamatos fejlődésével a tudósok végül képesek voltak megtisztítani a ritkaföldfémek elemeit. 1901 -ben Eugene de Marseille francia felfedezteEuropium- 1907-1908-ban az osztrák Wilsbach és Urbain francia függetlenül fedezték fel a Lutetiumot. Ezek a felfedezések fontos alapot nyújtottak a későbbi tudományos kutatásokhoz.
A modern tudomány és technológia területén az yttrium alkalmazása egyre szélesebb körű. A tudomány és a technológia folyamatos fejlődésével az YTTRIUM megértése és alkalmazása egyre mélyebbre válik.
A Yttrium elem alkalmazásmezői
1.Optikai üveg és kerámia:Az yttriumot széles körben használják optikai üveg és kerámia előállításában, elsősorban az átlátszó kerámia és az optikai üveg előállításában. Vegyületei kiváló optikai tulajdonságokkal rendelkeznek, és felhasználhatók lézerek, száloptikai kommunikáció és egyéb berendezések alkatrészeinek előállítására.
2. Foszforok:Az yttrium -vegyületek fontos szerepet játszanak a foszforokban, és fényes fluoreszcenciát bocsáthatnak ki, így gyakran használják TV -képernyők, monitorok és világító berendezések gyártására.Yttrium -oxidés más vegyületeket gyakran lumineszcens anyagként használnak a fény fényerejének és tisztaságának fokozására.
3. Ötvözet -adalékanyagok: A fémötvözetek előállításában az yttriumot gyakran additívként használják a fémek mechanikai tulajdonságainak és korrózióállóságának javítására.Yttrium ötvözetekgyakran használják nagy szilárdságú acél ésalumíniumötvözetek, hogy hőálló és korrózióállóbbá tegyék őket.
4. Katalizátorok: Az yttrium -vegyületek fontos szerepet játszanak egyes katalizátorokban, és felgyorsíthatják a kémiai reakciók sebességét. Az ipari termelési folyamatokban az autó kipufogógáz -tisztító eszközök és katalizátorok gyártására használják, elősegítik a káros anyagok kibocsátásának csökkentését.
5. Orvosi képalkotó technológia: Az yttrium izotópokat az orvosi képalkotó technológiában használják radioaktív izotópok előállításához, például a radiofarmakonok címkézéséhez és a nukleáris orvosi képalkotás diagnosztizálásához.
6. Lézeres technológia:Az yttrium ion lézerek egy általános szilárdtest-lézer, amelyet különféle tudományos kutatásokban, lézergyógyászatban és ipari alkalmazásokban használnak. Ezeknek a lézereknek a gyártása bizonyos yttrium -vegyületek aktivátorként történő felhasználását igényli.Yttrium elemekÉs vegyületeik fontos szerepet játszanak a modern tudományban, a technológiában, valamint az iparban, számos olyan területen, mint az optika, az anyagtudomány és az orvostudomány, és pozitívan hozzájárultak az emberi társadalom fejlődéséhez és fejlődéséhez.
Az yttrium fizikai tulajdonságai
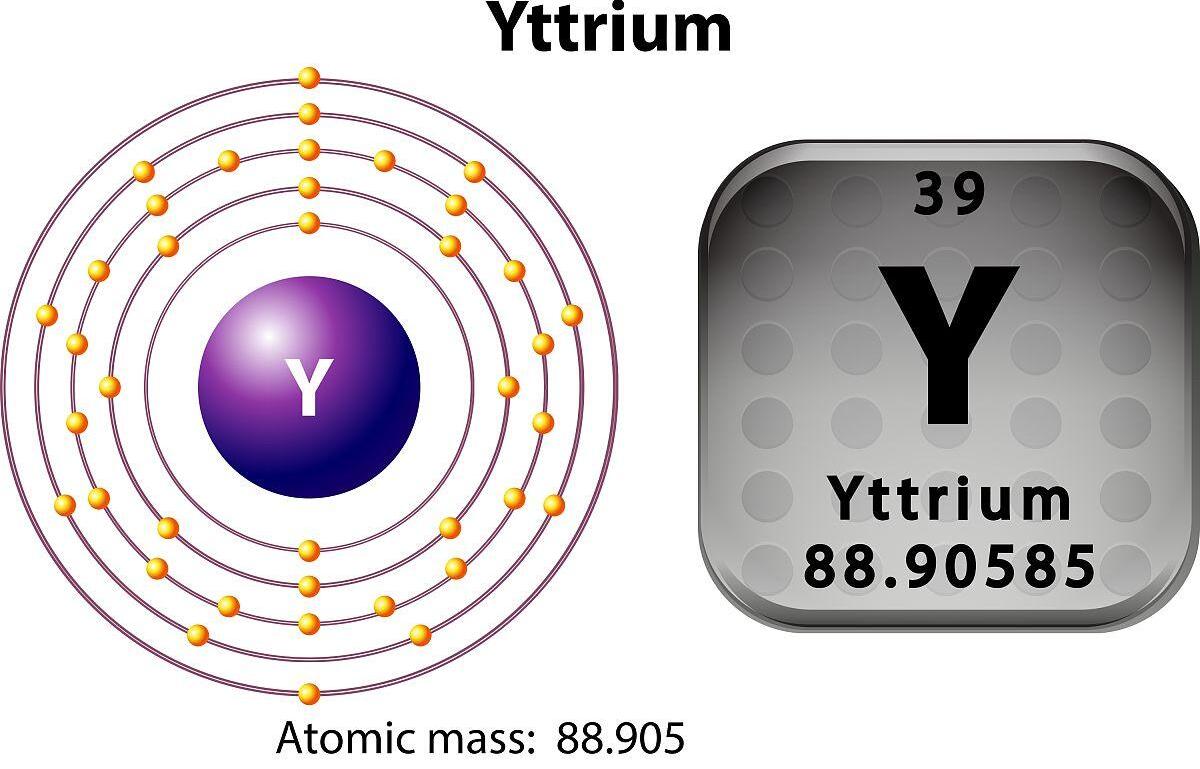
Az atomszámaittrium39, és kémiai szimbóluma Y.
1. Megjelenés:A Yttrium ezüstösfehér fém.
2. Sűrűség:Az yttrium sűrűsége 4,47 g/cm3, ami a Föld kéregének viszonylag nehéz elemeit teszi.
3. Olvadási pont:Az yttrium olvadási pontja 1522 Celsius fok (2782 Fahrenheit fok), amely arra a hőmérsékletre utal, amelyen az yttrium szilárdságról folyadékra változik hőviszonyok mellett.
4. forráspont:Az yttrium forráspontja 3336 Celsius fok (6037 Fahrenheit fok), amely arra a hőmérsékletre utal, amelyen az yttrium folyadékról gázra változik hőmérsékleten.
5. fázis:Szobahőmérsékleten az yttrium szilárd állapotban van.
6. Vezetőképesség:A Yttrium a nagy vezetőképességű villamosenergia -karmester, tehát bizonyos alkalmazásokkal rendelkezik az elektronikus eszközök gyártásában és az áramköri technológiában.
7. mágnesesség:A Yttrium egy paramágneses anyag szobahőmérsékleten, ami azt jelenti, hogy nincs nyilvánvaló mágneses válasz a mágneses mezőkre.
8. kristályszerkezet: Az yttrium hatszögletű, szorosan csomagolt kristályszerkezetben létezik.
9. atommennyiség:Az yttrium atommennyisége mólonként 19,8 köbcentiméter, ami egy mol yttrium atom által elfoglalt térfogatra utal.
A Yttrium egy fémes elem, amelynek viszonylag nagy sűrűségű és olvadási pontja van, és jó vezetőképességgel rendelkezik, tehát fontos alkalmazásokkal rendelkezik az elektronikában, az anyagtudományban és más területeken. Ugyanakkor a Yttrium szintén viszonylag gyakori ritka elem, amely fontos szerepet játszik egyes fejlett technológiákban és ipari alkalmazásokban.
Az yttrium kémiai tulajdonságai
1. Kémiai szimbólum és csoport: Az yttrium kémiai szimbóluma y, és a periódusos táblázat ötödik periódusában található, a harmadik csoport, amely hasonló a lantanid elemekhez.
2. Elektronikus szerkezet: Az yttrium elektronikus szerkezete 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4S² 4P⁶ 4D¹⁰ 4F¹⁴ 5S². A külső elektronrétegben az yttriumnak két valencia elektronja van.
3. Valencia állapot: A yttrium általában +3 valencia állapotát mutatja, amely a leggyakoribb valencia állapot, de a valencia állapotát +2 és +1 is mutathatja.
4. Reaktivitás: A YTTRIUM egy viszonylag stabil fém, de a levegőnek kitett, és fokozatosan oxidálódik, és oxidréteget képez a felületen. Ez miatt a Yttrium elveszíti csillogását. A yttrium védelme érdekében általában száraz környezetben tárolják.
5. reakció oxidokkal: Az yttrium reagál az oxidokkal, hogy különféle vegyületeket képezzen, beleértveyttrium -oxid(Y2O3). Az yttrium -oxidot gyakran használják foszforok és kerámia előállításához.
6.yttrium -klorid (Ycl3vagyyttrium -szulfát (Y2 (SO4) 3).
7. Vízzel való reakció: Az yttrium nem reagál közvetlenül a vízzel normál körülmények között, de magas hőmérsékleten vízgőzzel reagálhat, hogy hidrogén- és yttrium -oxidot termeljen.
8. Szulfidokkal és karbidokkal való reakció: Az yttrium reagálhat szulfidokkal és karbidokkal, hogy megfelelő vegyületeket képezzen, mint például az yttrium -szulfid (YS) és a yttrium -karbid (YC2). 9. Izotópok: Az yttriumnak több izotópja van, amelyek közül a legstabilabb a YTTRIM-89 (^89Y), amelynek hosszú felezési ideje van, és a nukleáris gyógyászatban és az izotóp jelölésében használják.
A Yttrium egy viszonylag stabil fém elem, többszörös valenciaállapotokkal, és képes reagálni más elemekkel vegyületek kialakításához. Az optika, az anyagtudomány, az orvostudomány és az iparág széles körű alkalmazásait tartalmazza, különösen a foszfor, a kerámia gyártás és a lézertechnika területén.
Az yttrium biológiai tulajdonságai
A biológiai tulajdonságaiittriumAz élő szervezetekben viszonylag korlátozottak.
1. jelenlét és lenyelés: Noha az yttrium nem elengedhetetlen az élethez, a természetben a nyomkövetési mennyiség megtalálható, beleértve a talajt, a sziklákat és a vizet. Az organizmusok az élelmiszerláncon keresztül, általában a talajból és a növényekből származhatnak az élelmiszerláncon keresztül.
2. biohasznosulás: A yttrium biológiai hozzáférhetősége viszonylag alacsony, ami azt jelenti, hogy az organizmusoknak általában nehezen tudnak felszívni és hatékonyan felhasználni az yttriumot. A legtöbb yttrium -vegyület nem könnyen felszívódik az organizmusokban, ezért általában ürülnek.
3. Eloszlás az organizmusokban: A szervezetben egyszer az yttrium elsősorban olyan szövetekben oszlik meg, mint a máj, a vese, a lép, a tüdő és a csontok. Különösen a csontok magasabb koncentrációt tartalmaznak a yttriumban.
4. anyagcsere és kiválasztás: A yttrium metabolizmusa az emberi testben viszonylag korlátozott, mivel általában a szervezetet ürítéssel hagyja el. Ennek nagy részét a vizeleten keresztül ürítik ki, és ürítés formájában is kiválasztható.
5. Toxicitás: Az alacsony biohasznosulási képesség miatt az yttrium általában nem halmozódik fel a normál organizmusok káros szintjére. A nagy dózisú yttrium-expozíció azonban káros hatással lehet az organizmusokra, ami toxikus hatásokhoz vezet. Ez a helyzet általában ritkán fordul elő, mert a természetben az yttrium -koncentráció általában alacsony, és nem használják széles körben használják vagy nem vannak kitéve az organizmusoknak. Az organizmusok biológiai tulajdonságai elsősorban a nyomkövetési mennyiségben, az alacsony biológiai hozzáférhetőségben, és nem az élethez szükséges elemben nyilvánulnak meg. Noha a normál körülmények között nincs nyilvánvaló toxikus hatása az organizmusokra, a nagy dózisú yttrium-expozíció egészségügyi veszélyeket okozhat. Ezért a tudományos kutatások és a megfigyelés továbbra is fontosak az yttrium biztonsága és biológiai hatásai szempontjából.
Az yttrium természetének eloszlása
A Yttrium egy ritkaföldfémi elem, amely viszonylag széles körben elterjedt a természetben, bár nem létezik tiszta elemi formában.
1. A Föld kéregében bekövetkező előfordulás: A földkéregben a yttrium bősége viszonylag alacsony, átlagos koncentrációja körülbelül 33 mg/kg. Ez teszi a Yttrium -ot a ritka elemek egyikének.
A yttrium elsősorban ásványi anyagok formájában létezik, általában más ritkaföldfémek elemeivel együtt. Néhány fő yttrium ásványi anyag közé tartozik a Yttrium Iron Garnet (YIG) és a yttrium -oxalát (Y2 (C2O4) 3).
2. Földrajzi eloszlás: Az yttrium lerakódások az egész világon eloszlanak, de egyes területek gazdagok lehetnek a yttriumban. Néhány jelentős offtrium -lerakódás a következő régiókban található: Ausztrália, Kína, Egyesült Államok, Oroszország, Kanada, India, Skandinávia. Ez általában magában foglalja a savas kimosódási és kémiai elválasztási eljárásokat, hogy a nagy tisztaságú Yttriumot kapja.
Fontos megjegyezni, hogy a ritkaföldfémek, például a yttrium általában nem léteznek tiszta elemek formájában, hanem más ritkaföldfémek elemeivel keverednek. Ezért a magasabb tisztaságú yttrium extrahálása komplex kémiai feldolgozási és elválasztási folyamatokat igényel. Ezen felül aritkaföldfémek elemeikorlátozott, tehát fontos az erőforrás -gazdálkodás és a környezeti fenntarthatóság mérlegelése is.
Bányászat, extrahálás és olvasztás az yttrium elem
A Yttrium egy ritkaföldfémi elem, amely általában nem tiszta yttrium formájában létezik, hanem Yttrium érc formájában. Az alábbiakban bemutatjuk a Yttrium elem bányászati és finomítási folyamatának részletes bevezetését:
1. A Yttrium Ore bányászata:
KIVÉTELÉS: Először is, a geológusok és a bányászati mérnökök feltárási munkát végeznek az yttriumot tartalmazó betétek megtalálására. Ez általában magában foglalja a geológiai vizsgálatokat, a geofizikai feltárást és a minta elemzését. Bányászat: Miután megtalálják az Yttrium -ot tartalmazó letétet, az érc bányászik. Ezek a lerakódások általában magukban foglalják az oxidérceket, mint például a Yttrium Iron Garnet (YIG) vagy a yttrium -oxalát (Y2 (C2O4) 3). ORE -összetörés: A bányászat után az ércet általában kisebb darabokra kell bontani a későbbi feldolgozáshoz.
2.Kémiai kimosódás: A zúzott ércet általában egy olvasztóba küldik, ahol az yttriumot kémiai kimosódás révén extrahálják. Ez a folyamat általában savas kimosódási oldatot használ, például kénsavat, hogy feloldja a yttriumot az ércből. Szétválasztás: Miután a Yttrium feloldódott, általában keverik más ritkaföldfémi elemekkel és szennyeződésekkel. A magasabb tisztaságú yttrium kivonásához elválasztási folyamatra van szükség, általában oldószer -extrahálás, ioncsere vagy más kémiai módszerek felhasználásával. Csapadék: Az yttriumot elkülönítik más ritkaföldfémi elemektől megfelelő kémiai reakciók révén, hogy tiszta yttrium -vegyületeket képezzenek. Szárítás és kalcinálás: A kapott yttrium -vegyületeket általában meg kell szárítani és ki kell kalcinálni, hogy eltávolítsák a maradék nedvességet és szennyeződéseket, hogy végre megkapják a tiszta yttrium fémet vagy vegyületeket.
Az yttrium detektálási módszerei
Az yttrium általános detektálási módszerei elsősorban az atomabszorpciós spektroszkópia (AAS), az induktívan kapcsolt plazma tömegspektrometria (ICP-MS), a röntgen fluoreszcencia spektroszkópia (XRF) stb.
1. atom abszorpciós spektroszkópia (AAS):Az AAS egy általánosan használt kvantitatív elemzési módszer, amely alkalmas az oldatban lévő YTTRIM -tartalom meghatározására. Ez a módszer az abszorpciós jelenségen alapul, amikor a mintában lévő célelem elnyeli egy adott hullámhossz fényét. Először, a mintát mérhető formává alakítják az előkezelési lépésekkel, például a gázégés és a magas hőmérsékleten történő szárítás révén. Ezután a cél elem hullámhosszának megfelelő fényt a mintába továbbítják, a mintával abszorbeált fényintenzitást megmérik, és a mintában szereplő yttrium -tartalmat úgy számítják ki, hogy összehasonlítják egy ismert koncentráció standard YTTrium -oldattal.
2. Induktívan kapcsolt plazma tömegspektrometria (ICP-MS):Az ICP-MS egy nagyon érzékeny analitikai technika, amely alkalmas a jttrium-tartalom meghatározására folyékony és szilárd mintákban. Ez a módszer a mintát töltő részecskékké alakítja, majd tömegspektrométert használ a tömegelemzéshez. Az ICP-MS széles detektálási tartományt és nagy felbontású, és egyszerre meghatározhatja a több elem tartalmát. A YTTRIUM kimutatására az ICP-MS nagyon alacsony detektálási határértékeket és nagy pontosságot biztosíthat.
3. röntgenfluoreszcencia spektrometria (XRF):Az XRF egy nem pusztító analitikai módszer, amely alkalmas az yttrium-tartalom meghatározására szilárd és folyékony mintákban. Ez a módszer az elemtartalmat úgy határozza meg, hogy a minta felületét röntgenfelvételekkel besugározza, és megméri a mintában a fluoreszcencia spektrum jellegzetes csúcsintenzitását. Az XRF előnyei vannak a gyors sebességnek, az egyszerű működésnek és a több elem egyszerre történő meghatározásának képességének. Az XRF azonban beavatkozhat az alacsony tartalmú Yttrium elemzésében, ami nagy hibákat eredményez.
4. Induktívan kapcsolt plazma optikai emissziós spektrometria (ICP-OES):Az induktívan kapcsolt plazma optikai emissziós spektrometria egy nagyon érzékeny és szelektív analitikai módszer, amelyet széles körben használnak a több elem elemzésben. Elkatlétja a mintát, és plazmát képez az O fajlagos hullámhossz és O intenzitás méréséref yttriumEmisszió a spektrométerben. A fenti módszerek mellett vannak más, általánosan használt módszerek is az yttrium detektálására, ideértve az elektrokémiai módszert, a spektrofotometriát stb.
Az yttrium atom abszorpciós módszer specifikus alkalmazása
Az elemmérés során az induktívan kapcsolt plazma tömegspektrometria (ICP-MS) egy nagyon érzékeny és több elem-elemzési technika, amelyet gyakran használnak az elemek, beleértve az YTTrium koncentrációjának meghatározására. Az alábbiakban egy részletes eljárás az ICP-MS-ben az YTTrium tesztelésére:
1. minta előkészítése:
A mintát általában feloldják vagy diszpergálni kell egy folyékony formába az ICP-MS elemzéshez. Ezt kémiai feloldással, fűtés emésztéssel vagy más megfelelő előkészítési módszerekkel lehet megtenni.
A minta előkészítéséhez rendkívül tiszta feltételeket igényel a külső elemek általi szennyeződés megakadályozása érdekében. A laboratóriumnak meg kell tennie a szükséges intézkedéseket a minta szennyeződésének elkerülése érdekében.
2. ICP generáció:
Az ICP-t úgy állítják elő, hogy az argon vagy argon-oxigén vegyes gáz bevezetésével egy zárt kvarc plazma fáklyába kerül. A nagyfrekvenciás induktív kapcsolás intenzív plazma lángot eredményez, amely az elemzés kiindulópontja.
A plazma hőmérséklete körülbelül 8000-10000 Celsius fok, ami elég magas ahhoz, hogy a mintában lévő elemeket ionos állapotba alakítsa.
3. ionizáció és elválasztás:Amint a minta belép a plazmába, a benne lévő elemek ionizálódnak. Ez azt jelenti, hogy az atomok egy vagy több elektronot veszítenek, töltve töltött ionokat képezve. Az ICP-MS tömegspektrométert használ a különböző elemek ionjainak elválasztására, általában tömeg/töltés arányával (m/z). Ez lehetővé teszi a különböző elemek ionjainak elválasztását és később elemzését.
4. Tömegspektrometria:Az elválasztott ionok tömegspektrométerbe lépnek be, általában egy kvadrupol tömegspektrométer vagy mágneses szkennelési tömegspektrométer. A tömegspektrométerben a különböző elemek ionjait elválasztják és detektálják tömeg / töltési arányuk szerint. Ez lehetővé teszi az egyes elemek jelenlétének és koncentrációjának meghatározását. Az induktívan kapcsolt plazma tömegspektrometria egyik előnye a nagy felbontása, amely lehetővé teszi több elem egyszerre történő felismerését.
5. Adatfeldolgozás:Az ICP-MS által generált adatokat általában feldolgozni és elemezni kell a mintában szereplő elemek koncentrációjának meghatározása érdekében. Ez magában foglalja a detektálási jel összehasonlítását az ismert koncentrációk standardjaival, valamint a kalibrálás és a korrekció végrehajtását.
6. Eredményjelentés:A végeredményt az elem koncentrációjaként vagy tömeg százalékaként mutatjuk be. Ezek az eredmények különféle alkalmazásokban felhasználhatók, ideértve a földtudományt, a környezeti elemzést, az élelmiszer -tesztelést, az orvosi kutatást stb.
Az ICP-MS egy nagyon pontos és érzékeny technika, amely alkalmas több elem-elemzésre, beleértve az Yttriumot. Ez azonban komplex műszereket és szakértelmet igényel, tehát általában laboratóriumban vagy professzionális elemzési központban hajtják végre. A tényleges munka során ki kell választani a megfelelő mérési módszert a webhely sajátos igényei szerint. Ezeket a módszereket széles körben alkalmazzák a laboratóriumokban és az iparágakban a Ytterbium elemzésében és kimutatásában.
A fentiek összefoglalása után arra a következtetésre juthatunk, hogy a Yttrium egy nagyon érdekes kémiai elem, egyedi fizikai és kémiai tulajdonságokkal, ami nagy jelentőséggel bír a tudományos kutatásban és az alkalmazási területeken. Noha némi előrelépést tettünk annak megértésében, még mindig sok kérdés van, amelyek további kutatást és feltárást igényelnek. Remélem, hogy bevezetésünk segíthet az olvasóknak jobban megérteni ezt a lenyűgöző elemet, és ösztönözheti mindenki iránti szeretetét a tudomány és a feltárás iránti érdeklődés iránt.
További információkért plsvegye fel velünk a kapcsolatotalatt:
Tel & Whats: 008613524231522
Email:Sales@shxlchem.com
A postai idő: november-28-2024